Alexandre de Brevern - Thèse de Bioinformatique Moléculaire
Les protéines sont des polymères, des macromolécules biologiques primordiales dans l'ensemble du règne animal et végétal. Depuis la découverte de la structure de l'ADN (Acide Désoxyribo Nucléique), le dogme de la biologie moléculaire peut se résumer en trois points:
(1) l'ADN porte l'information génétique,
(2) cette information est transcrite en ARN mono-brin qui possède une information souvent codante,
(3) avec l'aide du complexe ribosomique, l'ARN est traduit en protéine.
Les protéines sont des successions d'acides aminés simples. Il en existe 20 principaux.
Un acide aminé est composé d'un carbone asymétrique dit carbone ![]() (C
(C![]() ).
Ce carbone tétravalent est lié (cf. figure 2.1) à une fonction amine NH2 (N: azote et H: hydrogène),
à un atome d'hydrogène H, à une fonction acide COOH et
à un radical, un groupement de taille plus ou moins important appelé chaîne latérale (R).
).
Ce carbone tétravalent est lié (cf. figure 2.1) à une fonction amine NH2 (N: azote et H: hydrogène),
à un atome d'hydrogène H, à une fonction acide COOH et
à un radical, un groupement de taille plus ou moins important appelé chaîne latérale (R).
|
Les acides aminés libres sont solubles dans l'eau du fait des groupements polaires qu'ils portent. Il existe plusieurs types de chaînes latérales (R) qui se différencient selon leurs propriétés physico-chimiques :
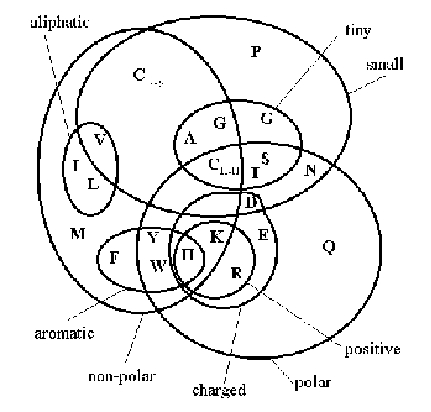
Ils se différencient aussi suivant leur encombrement stérique (cf. Tableau 2.1). Certains possèdent des cycles aromatiques comme la Phénylalanine, la Tyrosine et le Tryptophane. La Proline est le seul acide aminé dont la chaîne latérale est liée aussi à l'azote du squelette polypeptidique et donc dépourvu d'hydrogène. La Cystéine possède un groupement souffré qui peut s'oxyder, ce qui permet la création de pont disulfure qui peut stabiliser de manière primordiale la structure protéique. De nombreuses études portant sur les relations et les équivalences au niveau physico-chimique des acides aminés ont été menées. On peut noter le travail de William Taylor qui a mis au point une méthode de représentation simple prenant en compte à la fois les propriétés physico-chimiques, mais aussi le volume des acides aminés (cf. figure 2.2 [190]).
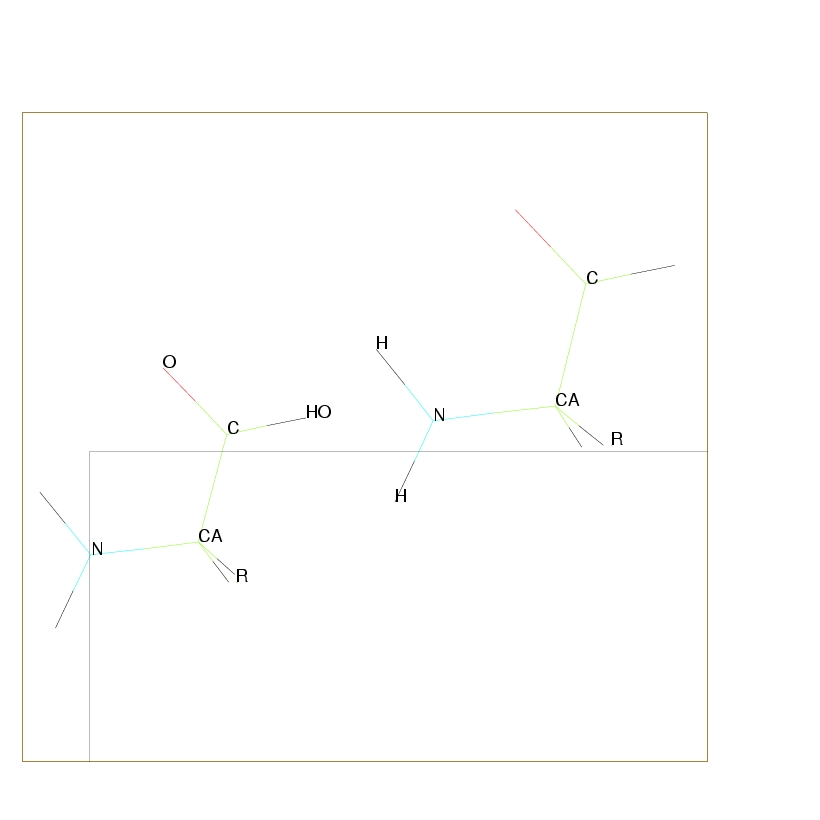
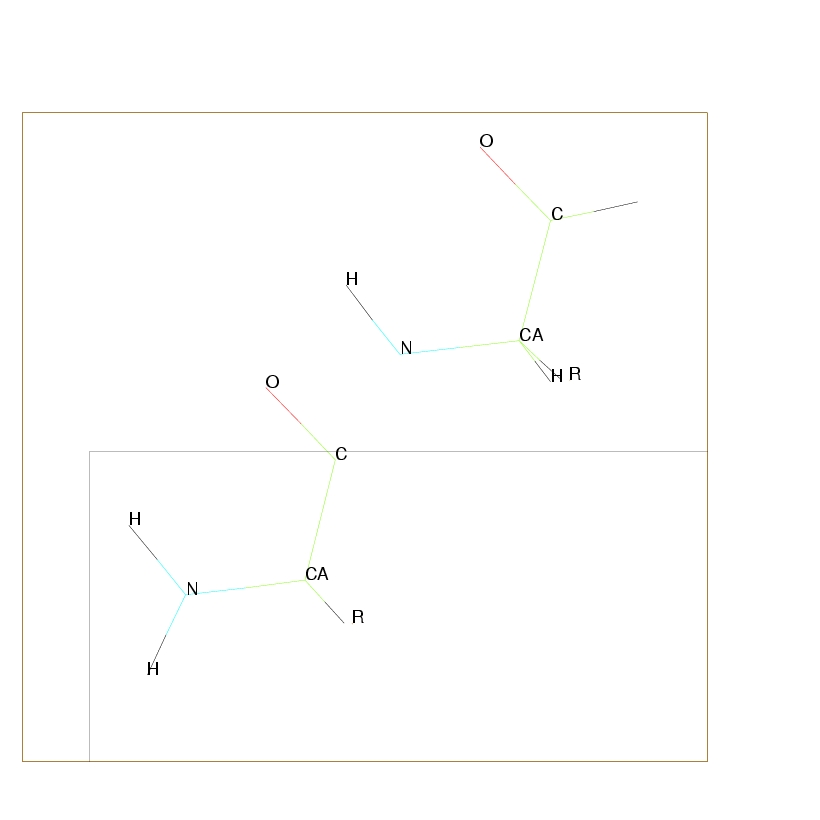
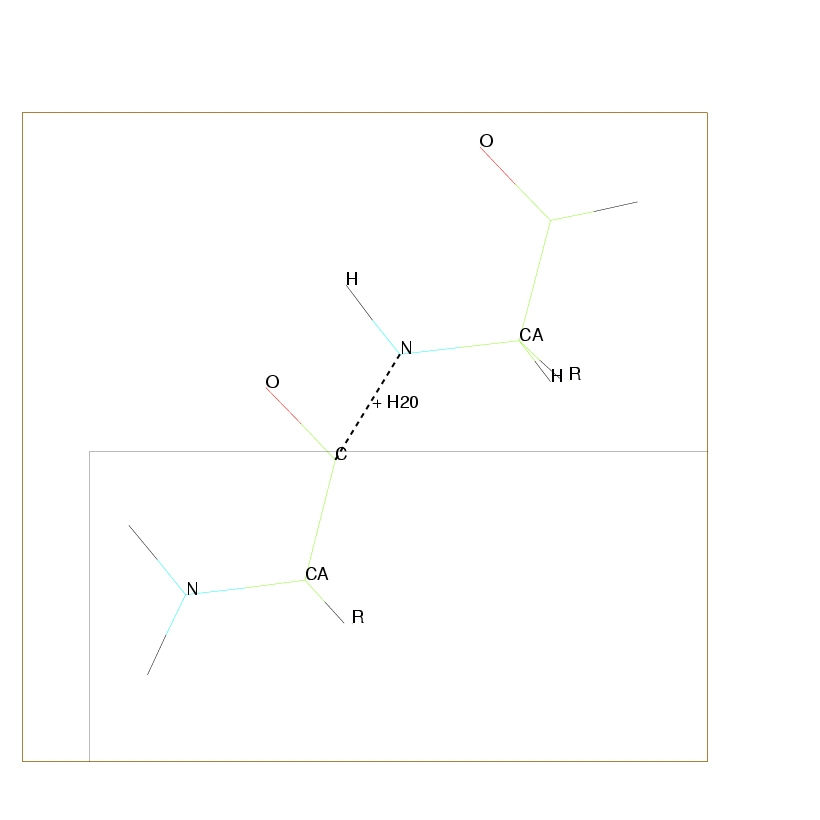
Deux acides aminés vont se lier en créant une liaison polypeptidique (cf. Figure 2.3),
par condensation entre le groupement carboxyle du premier et le groupement amine du second.
C'est une polymérisation qui s'effectue par perte d'une molécule d'eau.
Cette nouvelle liaison implique une rigidité importante. Quand le nombre d'acides aminés est faible, la macromolécule
est souvent nommée oligopeptide.
Un nombre important de résidus est nécessaire pour parler de polypeptide
ou protéine (les chiffres varient dans la littérature entre 20 et 50 résidus).
On distingue alors couramment la région axiale, monotone et de
composition constante (carbones et azote),
appelée squelette de la chaîne polypeptidique et
la succession des chaînes latérales variables selon le type d'acides aminés.
L'extrémité N-terminale correspondant au premier acide aminé de la
protéine porte un groupement amine encore libre et
l'extrémité C-terminale le dernier acide aminé de la
protéine avec un groupement carboxyle libre aussi.
Ces deux groupements à pH physiologique sont le plus souvent ionisés.
La synthèse s'effectue de l'extrémité N-terminale vers
l'extrémité C-terminale.
A remettre : la table des acides aminés
Prochain: Les différents niveaux de
Au-dessus: La structure protéique
Précédent: La structure protéique
Page 4